Тетрапарез и отеки как побочный эффект терапии противогрибковым препаратом: история болезни
72-летний мужчина долгие годы лечился от тяжелой астмы, при этом у него сохранялась относительно хорошая переносимость физических нагрузок. В течение двух лет у пациента развились одышка и продуктивный кашель, что потребовало обследования в клинике иммунопатологии. Его общий иммуноглобулин E (IgE) составлял 680 кЕ/л при норме 20-100 кЕ/л , а специфический IgE к Aspergillus fumigatus составлял 14,6 кЕ/л. Компьютерная томография органов грудной клетки выявила выраженную эмфизему легких и бронхоэктазы. На основании полученных результатов пациенту был поставлен диагноз тяжелой астмы с грибковой сенсибилизацией (SAFS – Severe asthma with fungal sensitisation) и назначен итраконазол по 200 мг два раза в день. Кроме того, пациент принимал: формотерола фумарат (ингаляторно, 6 мг, одна затяжка два раза в день), флутиказон (ингаляторно, 500 мг, одна затяжка два раза в день) и сальбутамол (через нибулайзер – 2,5 мг два раза в день). Через месяц терапии итраконазолом у пациента развился прогрессирующий двусторонний отек лодыжек (рис. 1). Анализ на уровень итраконазола в крови показал содержание вещества 17,5 мг/л (терапевтический диапазон 5-15 мг/л). Дозу препарата уменьшали до 200 мг один раз в день. Через месяц периферические отеки не ушли, и у пациента развилась слабость верхних и нижних конечностей. Признаков сердечной недостаточности не было, а уровень итраконазола в плазме крови составил 9,8 мг/л. Итраконазол полностью отменили, что привело к уменьшению отечности лодыжек, но сохранялась и нарастала слабость в конечностях. Через шесть недель пациент уже не мог двигаться и оказался прикованным к постели, после чего его направили в неврологический центр.
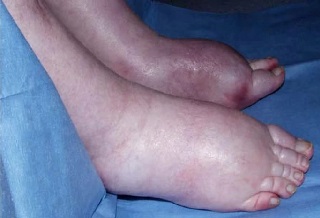
Рисунок 1. Периферический отек во время терапии итраконазолом
При поступлении у пациента выявлена умеренная двусторонняя слабость мышц лица. Тонус верхних конечностей – нормальный, но в обеих нижних конечностях сниженный. Мышечная сила в нижних конечностях была значительно снижена – до 2-3 баллов из 5, в верхних конечностях до 3-4 баллов. Рефлексы отсутствовали во всех четырех конечностях. Вибрационная чувствительность отсутствовала вплоть до бугристости большеберцовой кости. Суставно-мышечное чувство было ослаблено дистально до уровня плюсневых суставов, а тактильная чувствительность (проверялась уколами булавкой) снижена до уровня середины голени. Исследования нервной проводимости показали значительное ослабление моторных и сенсорных реакций без замедления проведения импульса, что соответствовало выраженной сенсорной и моторной аксональной полинейропатии.
Показатели крови были в основном нормальными, включая уровень креатинкиназы. Уровень лактатдегидрогеназы был слегка повышен до 490 МЕ/л (норма 105-333 МЕ/л), а уровень С-реактивного белка – до 21 мг/л (норма 0-10 мг/л). Функция щитовидной железы была нормальной, а уровень сывороточного альбумина был незначительно снижен, варьируя от 23 до 29 г/л во время болезни (норма 35-52 г/л). При биопсии икроножного нерва выявлена легкая аксональная нейропатия с признаками регенераторного процесса без признаков васкулита. Мышечная биопсия (из области передней большеберцовой кости) показала изменения мышечной ткани, характерные для денервации, признаков васкулита также не выявлено. В анализе цереброспинальной жидкости отклонений не было: лейкоциты <1/мкл, глюкоза 4.8 ммоль/л, белок – 0.4 г/л.
Маркеры аутоиммунных процессов (антинуклеарные антитела IgG, антитела к гладкой мускулатуре, митохондриям, ацетилхолиновому рецептору и другие) не были обнаружены в крови пациента. Скорость оседания эритроцитов составляла 70 мм/час (норма 0-65 мм / час). Общий IgE снизился до 236 кЕ/л ( был 680 кЕ/л), аспергиллез- специфический IgE снизился до 6,84 кЕ/л (ранее 14,6 кЕ/л), что свидетельствовало о хорошем ответе пациента на итраконазол. Хотя на начальном этапе дифференциальной диагностики подозревали аксональный синдром Гийена-Барре (аутоиммунное поражение периферических нервов), результаты иммунологических исследований и последующее течение заболевания сделали наиболее вероятным диагноз индуцированной итраконазолом нейропатии.
В неврологии пациент получил поддерживающую терапию, после чего последовала активная нейрореабилитация. Постепенное улучшение состояния произошло в течение двух месяцев, после чего пациент был выписан. Еще через шесть месяцев мужчина смог передвигаться самостоятельно с помощью двух локтевых костылей. Мышечная сила вернулась к 5 из 5 в дистальных отделах верхних и нижних конечностей и к 4/5 в проксимальных отделах.
Обсуждение
Итраконазол – противогрибковое средство, препарат широко используется для лечения нескольких форм микоза. Это был первый оральный препарат, обладающий активностью в отношении видов Aspergillus [1]. Итраконазол представляет собой синтетический триазольный противогрибковый агент, который был впервые обнаружен в 1980 году и лицензирован в 1991 году для лечения инвазивного аспергиллеза и некоторых эндемических микозов, таких как гистоплазмоз и споротрихоз. Он широко использовался для лечения различных аллергических, кожных и системных микозов, а также для лечения и профилактики грибковой инфекции у гематологических пациентов и пациентов после трансплантации [1]. Он также эффективен при аллергическом бронхолегочном аспергиллезе (АБЛА) и при тяжелой астме с грибковой сенсибилизацией (SAFS) [2, 3], которая была диагностирована у пациента. Побочные эффекты встречаются редко (менее 7%) и обычно незначительны [4, 5, 6]. Легкая степень периферической нейропатии регистрируется с частотой менее одной на 10000 [4]. Существуют многочисленные сообщения о случаях итраконазол-усиленной нейропатии при терапии винкристином, случаи объясняются замедлением метаболизма винкристина итраконазолом [8, 9, 10]. Описан случай болезненной нейропатии у пациента с сахарным диабетом 1 типа [11]. Однако о тяжелой нейропатии исключительно из-за итраконазола без какого-либо сопутствующего фактора риска, как в приведенном случае, до сих пор не сообщалось.
В последние годы итраконазол все чаще используется для лечения АБЛА и SAFS [2, 3]. Как правило, итраконазол хорошо переносится, сообщается только о легких побочных эффектах [4, 5, 6]. В клинических исследованиях общая частота нежелательных явлений составляет порядка 7% при кратковременном применении и до 15% при длительном применении – наиболее частыми являются желудочно-кишечные побочные эффекты [4, 6]. Отек лодыжки – редкое осложнение терапии итраконазолом – до 4% пациентов в клинических испытаниях [7], причем чаще страдают пациенты, получающие одновременно блокаторы кальциевых каналов. Механизм этого побочного эффекта остается неизвестным. Выраженный отек, требующий приостановки приема лекарств, как в описанном случае, является редким явлением, о котором сообщалось только один раз [7]. Хотя гипоальбуминемия (диапазон 23-29 г/л) присутствовала, возможно, усугубляя отечность, сама по себе она не должна была вызвать настолько выраженный отек, который наблюдался в описанном случае.
Среди других азольных препаратов в литературе имеется по меньшей мере четыре сообщения о том, что вориконазол вызывает болевую форму периферической нейропатии [12, 13, 14]. Позаконазол, несмотря на то, что является высоколипофильным препаратом, не упоминался как исключительная причина нейропатии, но существуют доказательства того, что он усиливает вызванную винкристином нейротоксичность [15, 16].
Несколько фактов поддерживают диагноз итраконазол-индуцированной нейропатии. Во-первых, показательна временная связь между началом отека лодыжки и нейропатией после начала приема итраконазола и постепенным восстановлением после прекращения приема препарата. Временная и дозозависимая картина аксональной сенсомоторной полинейропатии характерна именно для лекарственной нейропатии [17]. Во-вторых, хотя клинические признаки, имевшиеся у пациента, могли указывать на аксонный вариант синдрома Гийена-Барре, нормальный уровень белка в цереброспинальной жидкости снимал этот диагноз.
Теоретически возможен следующий механизм развития нейропатии в данном случае. Итраконазол является ингибитором цитохрома с высокой липофильностью и высокой способностью связываться с белками плазмы (99%) [18, 19]. Концентрация итраконазола в тканях в два-десять раз превышает концентрацию в плазме. Это и делает препарат эффективным, не смотря на низкую концентрацию итраконазола в плазме у некоторых пациентов. У нашего пациента изначально была высокая концентрация итраконазола в плазме крови, несмотря на стандартную дозировку. Концентрация в тканях, вероятно была еще выше, что и привело к развитию нейротоксичного эффекта. Последующее медленное выведение вызвало медленное постепенное восстановление нейронов, несмотря на раннее прекращение приема препарата [20]. Вообще, концентрация итраконазола в плазме зависит не только от дозы, но и от биохимических особенностей пациента, метаболизм препарата в печени и энтерогепатическую циркуляцию [21]. Следовательно, начальная дозировка не может предсказать концентрацию препарата в плазме в каждом конкретном случае. Поэтому разумно контролировать концентрацию итраконазола после первого приема и проводить дальнейший мониторинг при увеличении дозы.
Письменное информированное согласие было получено от пациента для публикации. Копия письменного согласия доступна для ознакомления и находится главного редактора журнала.
По материалам: Itraconazole associated quadriparesis and edema: a case report
- Polak A: Antifungal therapy - state of the art at the beginning of the 21st century. Prog Drug Res. 2003, Spec. No. 59-190
- Denning DW, O'Driscoll BR, Hogaboam CM, Bowyer P, Niven RM: The link between fungi and asthma - a summary of the evidence. Eur Respir J. 2006, 27 (3): 615-626. 10.1183/09031936.06.00074705.
- Denning DW, O'Driscoll BR, Powell G, Chew F, Atherton GT, Vyas A, Miles J, Morris J, Niven RM: Randomized Controlled Trial of Oral Antifungal Treatment for Severe Asthma with Fungal Sensitization: The Fungal Asthma Sensitization Trial (FAST) Study. Am J Respir Crit Care Med. 2009, 179 (1): 11-18. 10.1164/rccm.200805-737OC.
- Sporanox data sheet. http://medsafe.govt.nz/profs/Datasheet/s/Sporanoxcap.htm
- Tucker RM, Haq Y, Denning DW, Stevens DA: Adverse events associated with itraconazole in 189 patients on chronic therapy. J Antimicrob Chemother. 1990, 26 (4): 561-566. 10.1093/jac/26.4.561.
- Böhme A, Just-Nübling G, Bergmann L, Shah PM, Stille W, Hoelzer D: Itraconazole for prophylaxis of systemic mycoses in neutropenic patients with haematological malignancies. J Antimicrob Chemother. 1996, 38 (6): 953-961.
- Tailor SA, Gupta AK, Walker SE, Shear NH: Peripheral edema due to nifedipine-itraconazole interaction: a case report. Arch Dermatol. 1996, 132 (3): 350-352. 10.1001/archderm.132.3.350.
- Jeng MR, Feusner J: Itraconazole-enhanced vincristine neurotoxicity in a child with acute lymphoblastic leukaemia. Pediatr Hematol-Oncol. 2001, 18 (2): 137-142. 10.1080/088800101300002973.
- Bashir H, Motl S, Metzger ML, Howard SC, Kaste S, Krasin MP, Hudson MM: Itraconazole-enhanced chemotherapy toxicity in a patient with Hodgkin lymphoma. J Pediatr Hematol-Oncol. 2006, 28 (1): 33-35.
- Bermúdez M, Fuster JL, Llinares E, Galera A, Gonzalez C: Itraconazole related increased vincristine neurotoxicity: case report and review of literature. J Pediatr Hematol Oncol. 2005, 27 (7): 389-392.
- Singh R, Cundy T: Itraconazole-induced painful neuropathy in a man with type 1 diabetes. Diabetes Care. 2005, 28 (1): 225-10.2337/diacare.28.1.225.
- Tsiodras S, Zafiropoulou R, Kanta E, Demponeras C, Karandreas N, Manesis EK: Painful peripheral neuropathy associated with voriconazole use. Arch Neurol. 2005, 62 (1): 144-146. 10.1001/archneur.62.1.144.
- Aksoy F, Akdogan E, Aydin K, Yilmaz M, Altunayoglu V, Sozen EE, Omay SB, Koksal I: Voriconazole induced neuropathy. Chemotherapy. 2008, 54 (3): 224-227. 10.1159/000140466.
- Gendrot A, de La Blanchardière A, de La Gastine B, Fromager G, Massias L, Verdon R: Painful peripheral neuropathy associated with voriconazole during the treatment of chronic cavitary pulmonary aspergillosis. Rev Med Interne. 2010, 31 (2): 163-166. 10.1016/j.revmed.2009.02.021.
- Jain S, Kapoor G: Severe life threatening neurotoxicity in a child with acute lymphoblastic leukemia receiving posaconazole and vincristine. Pediatr Blood Cancer. 2010, 54 (5): 783-10.1002/pbc.22399.
- Eiden C, Palenzuela G, Hillaire-Buys D, Margueritte G, Cociglio M, Hansel-Esteller S, Peyriere H: Posaconazole-increased vincristine neurotoxicity in a child: a case report. J Pediatr Hematol Oncol. 2009, 31 (4): 292-295. 10.1097/MPH.0b013e31819b9d01.
- Peltier AC, Russell JW: Recent advances in drug-induced neuropathies. Curr Opin Neurol. 2002, 15 (5): 633-638. 10.1097/00019052-200210000-00015.
- Leyden J: Pharmacokinetics and pharmacology of terbinafine and itraconazole. J Am Acad Dermatol. 1998, 38 (5 Pt 3): S42-S47. 10.1016/S0190-9622(98)70483-9.
- Willems L, van der Geest R, de Beule K: Itraconazole oral solution and intravenous formulations: a review of pharmacokinetics and pharmacodynamics. J Clin Pharm Ther. 2001, 26 (3): 159-169. 10.1046/j.1365-2710.2001.00338.x.
- Prentice AG, Glasmacher A: Making sense of itraconazole pharmacokinetics. J Antimicrob Chemother. 2005, 56 (suppl 1): i17-i22. 10.1093/jac/dki220.
- Hardin TC, Graybill JR, Fetchick R, Woestenborghs R, Rinaldi MG, Kuhn JG: Pharmacokinetics of itraconazole following oral administration to normal volunteers. Antimicrob Agents Chemother. 1988, 32 (9): 1310-1313.





